Sizden gelen soru:
* Amonyak hangi alanlarda kullanılır? *
Cevap:
Amonyak Kullanım Alanları
Amonyak, gübre, ilaç, boya, parfüm gibi maddelerin sentezlenmesinde ilk aşamada kullanılmaktadır. Amonyak canlılar için zehirli bir maddedir, kullanılırken dikkat edilmesi gerekir. Piyasada amonyak adı altında satılan maddeler amonyağın sulu çözeltisi olan Amonyum Hidroksittir.
Kullanım alanları
Kullanım alanları aşağıda belirtilmiştir:
- Boyalarda
- Parfümlerde
- Temizlik malzemelerinde
- Patlayıcılarda
- Gübre yapımında
- Sanayide
- Nitrik asitin üretiminde
- Ürede
- Plastiklerde
Sanayide önemli oranda amonyak, nitrik asit, nitrat ve nitrit durumuna getirilmektedir. Ayrıca Rolvay yöntemiyle soda (sodyum karbonat ) elde etmek için yararlanılmaktadır. Bugün amonyak en çok pekrolden elde edilen hidrojenle, hava azotundan elde edilir. Amonyaktan gübre sanayiinde ve patlayıcı madde yapımında yararlanılır.
Doğal olarak toprakta mikroorganizmaların etkisiyle gerçekleşen nitratlaşma olayı NaN03 (sodyum nitrat) ve KNO3 (potasyum nitrat) gibi tabi gübreler oluşturur. Amonyum klörür (NH4 Gl) ya da nisadır, kuru pillerde ve lehim işlerinde kullanılır. Amonyak çözeltisi kumaş lekelerini çıkarmada, gümüş eşya parlatılması ve temizlenmesinde, tıpta böcek sokmalarına karşı yarayı dezenfekte edici o-larak kullanılır. Sıvı amonyak soğutma tesislerinde kullanılır.
Amonyak, gübre, ilaç, boya, parfüm gibi maddelerin sentezlenmesinde ilk aşamada kullanılmaktadır. Amonyak ayrıca temizlik maddelerinde de kullanılır. Amonyak canlılar için zehirli bir maddedir, kullanılırken dikkat edilmesi gerekir.
Amonyak Hakkında Bilgiler
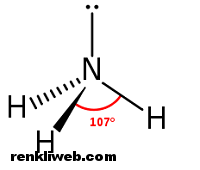
Amonyak, formulü NH3 olan; azot atomu ve hidrojen atomundan oluşan renksiz ve keskin ve hoş olmayan kokuya sahip bir gaz bileşiğidir. OH– iyonu içermediği halde su da zayıf baz özelliği gösterir. Bir amonyak molekülü, bir azot ve üç hidrojen atomundan oluşur.
Yapısı
Amonyak, kovalent bağlı (ametal + ametal) bir bileşiktir. Molekülleri polar olduğundan su içinde yüksek oranda çözünür. Amonyak molekülleri kendi aralarında olduğu gibi su molekülleri ile de zayıf hidrojen bağı oluşturur. Bu nedenle suda çok çözünür.
- Yaptığı bileşikte, sp3 hibritleşmesi yapmıştır.
- Bağ yapmamış bir çift elektronu olduğundan molekül şekli üçgen piramittir, bu yüzden polar bir moleküldür.
- Gazlaşma gizli ısısı çok yüksektir, bu nedenle sanayi tesislerinde soğutucu madde olarak da kullanılır.
Çözünürlüğü
- Oda koşullarında doymuş amonyak çözeltisi %34’lük olup, yoğunluğu 0,88 g/ml’dir.
- 1 atm basınç ve 0 °C de 1300 litre, 1 atm basınç ve 20 °C de 700 litre amonyak çözünür.
- 1 atm basınçta kaynama noktası -33,33 °C (239,82 K) dir. -77,73 °C (195,42 K) donduğundan, oda koşullarında gaz halinde bulunur.