Asit ve Bazlar
Asitler ve bazlar çevremizde gördüğümüz her türlü sıvı kimyasal tepkimelerini açıklamak üzere geliştirilmiş iki tanımdır. Aslında sandığımız gibi asit ve bazlar sadece laba tuvar şartlarında bulunmuyor. Kolaylıkla yaşadığımız çevrede görebileceğimiz bir çok sebze ve meyvede bile bulunmaktalar. Bu nedenle asit ve bazları daha geniş ve daha özel bir şekilde tanımlama ihtiyacı duyulmuştur. Konuyla ilgili daha ayrıntılı bilgiyi ve birkaç çözümlü örneği aşağıda bulabilirsiniz.
Asitlerin ve bazların tanımı, kimyada şüphesiz en önemli ve yararlı tanımlardan biridir. Gerçekte hemen hemen bütün kimyasal tepkimeleri, asit-baz tepkimeleri veya yükseltgenme-indirgenme tepkimeleri olarak sınıflandırma olanağı vardır. Günümüze dek asit ve bazlar için çeşitli tanımlar yapılmıştır. Asitler ve bazlar için yapılan ilk tanım sulu çözeltilerde gözlenen özelliklerine dayanır. Sulu çözeltilerinin ekşimsi bir tadı olan ve turnusol kağıdını kırmızıya dönüştüren maddelere asit denir. Bazların sulu çözeltilerinin acımsı bir tadı vardır ve turnusol kağıdını maviye dönüştürürler. Atomların ve moleküllerin yapıları ile ilgili bilginin gelişmesi, kimyacıları asitlerin ve bazların yapıları ile özellikleri arasında bağıntı aramaya zorlamıştır
Asitler
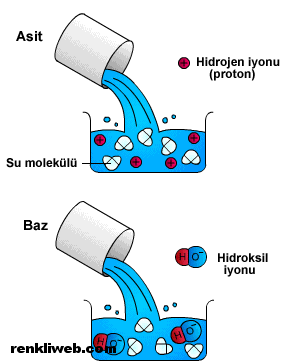
Asitler, suyla hidrojen iyonları üreten hidrojen bileşimleridir. Hidrojen iyonları çözeltiyi asidik yapar. Asitler mavi turnusol kağıdına kırmızı renk verir. Eski Türkçe’de hamız, ve bazı kaynaklarda da ekşit denir.
Gıdaların çoğu asit içerir. Limonda sitrik asit, sirkede ise asetik asit bulunur. Farklı asitler, limona, sirkeye, ekşi elmaya ve şerbete keskin tadını verir. Aküler, sülfürik asit; midedeki sindirim sıvıları, hidroklorik asit içerir. Asitler, suda eridiğinde hidrojen iyonları (H+) üreten madde çözeltileridir. Asit maddelerin çoğu, saf katılar, sıvılar ya da gazlar olarak bulunsa da, sadece suda eridiğinde asit gibi tepki verir.
Özellikleri
Asitler, çözeltiye hidrojen iyonu bırakan bileşiklerdir. Bütün asitler hidrojen (H+) içerir. Genelde;
1- Ekşi bir tada sahiptirler 2- İndikatörlerin rengini değiştirirler. (Asitler mavi turnusol kağıdını kırmızıya çevirirler). 3- Bazlarla tepkimeye girdiklerinde tuz ve su oluştururlar. Bundan başka çok çeşitlilik gösteren başka özellikleri de bulunur. Bu spesifik özellikler, anyon muhtevası ve ayrılmamış molekülerden dolayı olur. Çeşitli asitlerin molekülleri, çözeltiye farklı miktarda serbest Hidrojen bırakma eğilimindedirler.
Bazlar
Baz, suda iyonlaştığında Brønsted-Lowry asit-baz teorisine göre ortama OH– (hidroksit) iyonu, Lewis asit-baz teorisine göre ise elektron çifti verebilen maddedir.
Bazların kullanıldığı yerler ve formülleri
- Sodyum hidroksit (NaOH): Sabun, lavabo açıcı.
- Potasyum hidroksit (KOH): Arap sabunu, sıvı sabun, şampuan.
- Kalsiyum hidroksit (Ca(OH)2): Sıva ve harç.
- Alüminyum hidroksit (AL(OH)3): Deodorantlar.
- Magnezyum hidroksit (Mg(OH)2): antiasit.
- Amonyak (NH3): Ev temizlik malzemesi, gübre, patlayıcı madde.(Zayıf bazdır)
Bazlar da, asitler gibi tehlikeli maddelerdir.Bazların genel tanımı şu şekildedir:
Sulu çözeltilerinde hidroksit (OH–) iyonu bulunduran maddelere baz denir.
Örnekler ve Çözümleri
Örnek – 1
Bir asit çözeltisinin [H+] derişimi 1.10–3 M ise bu çözeltinin pH ve pOH’ı nedir?
Çözüm
[H+] = 1.10–3 M ise
pH = –log[H+]
pH = –log[1.10–3]
pH = 3
pOH = 11 olarak bulunur.
Örnek – 2
0,1 M lık HA asitinin pH =3 tür. Buna göre, asitin Ka sı kaçtır?
Çözüm
pH = 3 ise [H+] = 1.10–3 olduğundan,
[A–] = 1.10–3 olacaktır.
9 ihmal edilir.
0,1 in yanında 1.10–3 çok küçük olduğundan ihmal edilir.
Ka = 1.10–5 olarak hesaplanır.
Örnek – 3
1) Asitlerin tadları ekşidirAşağıdaki çözeltilerden hangisinde asit bulunmaz?
A)Portakal suyu B) Limonata C) Vişne suyu
D)Sirke E) Sabunlu su
Çözüm
Verilen ilk dört örneğin tadları ekşidirBu maddelerde asit vardırSabunla suyun tadı acıdırYapısında asit yoktur CEVAP: E
2)Aşağıdakilerden hangisi asit özelliklerinden değildir?
A)Sulu çözeltileri elektrik akımını iletir
B)Kırmızı turnusol kağıdını mavi renge dönüştürürler
C)Seyreltik çözeltilerin tadı ekşidir
D)Bazlarda tuz oluştururlar
CEVAP:B
Örnek – 4
0,05 M HCl çözeltisinin pH sını bulunuz.
Çözüm
[H3O+] = [HCl] = 0,05 M
pH = -log 0,05 = 1,30
Aynı durum kuvvetli bazlar için de geçerlidir.
pOH = -log CB dir.
Derişimin 10-6 M dan küçük olması durumunda suyun iyonlaşma etkisini göz önüne alacağımızdan çözeltideki OH- derişimi için aşağıdaki eşitliliği yazmamız gerekir.
[OH-] = CB + [OH-]su
[OH-]su = [H3O+]su = C olduğundan
Ksu = (CB+C) . C = 1,00.10-14
C2 + CB . C � 1,00.10-14 = 0 dır.
Bu eşitliğin çözümü ile C yani sudan gelen hidroksit iyonu derişimi bulunur, CB ye eklenerek çözeltideki hidroksit derişimine geçilir ve pOH hesaplanır.
Örnek – 5
100 ml 0,050 M NaOH ile 100 ml 0,020 M Ca(OH)2 çözeltileri karıştırılıyor. Elde edilen çözeltinin pOH ve pH değerleri nedir?
Çözüm
0,05 0,05 0,05
0,020 0,020 2x(0,020)
İki tane ayrı baz çözeltisinin karıştırılması ile oluşan yeni çözeltide hidroksit iyonu derişimi şöyle bulunur.
Çözeltideki toplam OH- iyonu, NaOH ve Ca(OH)2 tarafından verilir. Her iki çözeltiden 100�er mL alındığından çözeltinin son hacmi 200 mL olur.
M = n/V formülünde hacim değiştiği için molarite de değişecek. Öncelikle M x V formülünden yeni mol sayısı (n) bulunur. Daha sonra bu mol sayısı (n) toplam hacime (V) bölünerek yeni derişim bulunur.
[OH-] = (100 x 0, 050+ 100 x 0, 040) / 200 = 4,50.10-2 M
pOH = -log 4,50.10-2 = 2-log 4,50 = 2-0,65 = 1,35
pH = 14-pOH = 14-1,35 = 12,65

“Asit ve Bazlar İle İlgili Örnekler” için 4 yanıt
çoooooooook zooooooooooor ders yaa abi bu ne yaaaaaaaaaaaaaaaaaaaaa
oooooooooo kocim napan teyyaRE
tşk edrim.mucklarımı iletirim:) 😀
çook tşklr ödevden artı aldım… :)))) :ppppp