Sizden gelen soru:
Periyotların ve grupların özellikleri ve özel isimleri?
Cevap:
Periyotlar ve Özellikler
Bir elementin elektron dizilişine bakıldığında en dış enerji seviyesine ait numara o elementin yer aldığı periyot numarasını gösterir. Buna göre 1s22s22p1dağılımına sahip elementin yer aldığı periyot en dış enerji seviyesi iki numaralı seviye olduğu için 2 dir. 1s22s22p63s23p5 dağılımına sahip element 3. periyotta, 1s22s22p63s23p64s1 elektron dizilişine ait element ise 4. periyottadır.
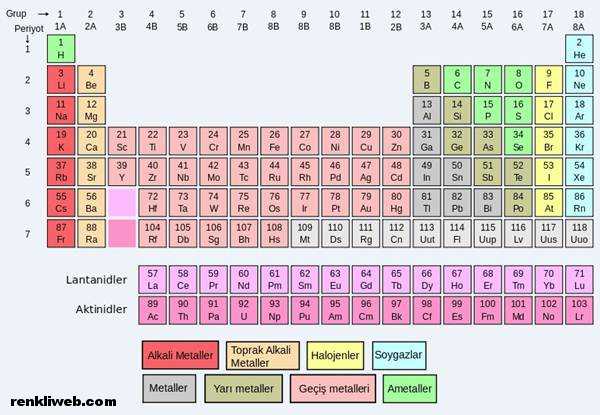
Periyotlarda yer alan element sayısı değişiktir. Periyodik cetvelde artan atom numarasına göre elementler sıralanır. Buda elektron dağılımına eklenecek yeni bir elektron demektir. Bir enerji düzeyinin elektronla tamamen dolması ile periyot sonlanır. Yani her periyot 8 a grubu ile biter. Yeni gelen elektron bir sonraki periyodun 1 a grubuna yerleşir.
1. periyotta sadece iki element vardır. 1s1 elektron dağılımına sahip hidrojen 1 a grubunda 1s2 elektron dağılımına sahip helyum 8 a grubunda yer alır.
2. periyot atom numarası 3 olan lityum ile başlar 2. enerji düzeyinde yer alan orbitaller (2s ve 2 p ) 8 elektron alacağı için bu periyoda toplam 8 element yerleşir. Periyot atom numarası 10 olan neon ile biter.
3. periyot sodyum ile başlar. Bu peryottada 8 element yer alır. Atom numarası 18 olan argon atomlarında 3. enerji seviyesindeki orbitaller (3s ve 3p) tam doludur. Bunun için periyodun son elementi argondur.
4. periyot atom numarası 19 olan potasyum ile başlar elektron dağılımı 4 s1 dir. 21 atom numaralı skandiyum ile 3 d orbitalleri dolmaya başlar. Atom numarası 30 olan çinko ile 3 d orbitallerinin doluşu biter. D orbitalleri 10 elektron alabileceği için periyoda 2. ve 3. periyotlara göre 10 element fazladan girer. 31. elementte 4 p orbitalleri dolmaya başlar ve 36. element olan kriptonla periyot tamamlanır. Böylelikle bu periyotta toplam 18 element yer alır.
5. periyotta 4. periyot gibi 18 element bulunur. 5. periyot 37 atom numaralı rubidyum ile başlar 54 atom numaralı kısenon ile sonlanır. Bu arada 5 s 4 d 5 p orbitallerine elektron yerleşir.
6. periyot; 6 s, 4 f, 5 d, 6 p orbitalleri elektron alabileceği için toplam 32 element alır. Periyot 55 atom numaralı sezyum ile başlar 86 atom numaralı radon ile biter. 4 f orbitallerinin dolması ile periyoda yerleşen 14 adet elemente ilk üyeleri olan lantan elementine benzerliklerinden dolayı lantanitiler denir. Ve bu 14 element aynı zaman da f blokunda yer alır.
7. periyot atom numarası 87 olan fransiyum ile başlar periyot tamamlanmıştır. Şimdilik 26 element bulunmaktadır. Bu periyottaki 5 f orbitallerinde elektron bulunduran elementler f bloğunun 2. sırasını oluşturur. Aktinyum elementi ile benzer özellikler gösterdiği için aktinitler olarak bilinirler.
Gruplar ve Özellikleri
Bir elementin fiziksel ve kimyasal özelliğinden elektron dağılımı sorumludur. Özellikle son enerji düzeyindeki elektronlar son derece belirleyicidir. Son enerji düzeyindeki elektronlar aynı zamanda elementin bulunduğu grubun numarasını da belirler.
Grupların isimleri;
- 1A Alkali metaller
- 2A Toprak alkali metaller
- 3A Toprak metalleri
- 4A Karbon grubu
- 5A Azot grubu
- 6A Oksijen grubu
- 7A Halojenler
- 8A Soygazlar(asal gazlar)
Alkali Metaller
Periyodik cetvelin 1 a grubunda yer alırlar. Bu grupta yer alan elementlerin hidrojen hariç hepsi metaldir. Fransiyum doğada bulunmaz. Ancak yapay olarak elde edilir. Ve radyoaktif özelliktedir. Bu grup elementleri a metal elementlerle kolaylıkla tepkiye girer. Bu yüzden doğada serbest olarak bulunmazlar. Son enerji düzeylerindeki bir elektronu çok kolay vererek bileşiklerinde +1 değerlikli olurlar. Elektron verme istekleri grupta yukarıdan aşağı gidildikçe artar. Erime noktaları düşüktür. Grupta yukarıdan aşağıya düşer.
Toprak alkali metaller alkali metallere benzer özellikler gösterir. 2 a grubunda bulunan bu elementler ns2 elektron dağılımına sahip oldukları için bileşiklerinde +2 değerlikli olurlar.
HALOJENLER
7 a grubunda yer alan bu elementler ns2 np5 dağılımından dolayı kolaylıkla elektron alabilirler. Bu yüzden bileşik yapmaya çok isteklidirler. Bu istekleri periyodik cetvelde yukardan aşağı gidildikçe azalır. Oda koşullarında grubun üyelerinden fluor ve klor gaz, brom sıvı, iyot ise katı haldedir. Astatin doğal olarak bulunmaz. Ancak laboratuar şartlarında elde edilir ve radyoaktiftir. Hepsi a metal özellikler gösterirler. Hidrojen ile asit özellikte bileşikler yaparlar.
Soy Gazlar
8 a grubunda bulunurlar. Grupta yukarıdan aşağı helyum, neon, argon, kripton, ksenon, radon şeklinde sıralanırlar. Son enerji düzeyleri tamamen dolu olduğu için en kararlı elementlerdir. Bu yüzden tepkime vermeleri bileşik oluşturmaları çok zordur. Oda sıcaklığında hepsi gaz halindedir. Radon radyoaktiftir.
Element Özelliklerinin Periyodik Cetveldeki değişimi
Elementlere ait özelliklerin periyodik cetvelde bir periyot boyunca soldan sağa ve bir grupta yukarıdan aşağı nasıl bir değişim gösterdiği, karşılaştırma yapmak açısından önemlidir. Şimdi elementler için önemli bazı özelliklerin periyotlardaki ve gruplardaki değişimi inceleyelim.
Metalik Özellik
Bir periyot boyunca elementlerin metalik özellikleri soldan sağa doğru azalır. Bu yüzden periyodik cetvelin 3A grubunun solunda kalan elementler bütünü ile metal özellikler gösterir. Sağa gidildikçe ametal özellikler artar. Başka bir deyimle elektron verme isteği azalır, alma isteği artar. Elektriksel iletkenlikleri artar. Oksitlerin bazik özelliği artar.
Atom Yapıları ve Atom Hacmi
Bir atom hacmi atom yarıçapı ile doğru orantılı olduğu için atom yarıçapı aynı zamanda atom hacmini de belirler.
Bir periyot boyunca sodan sağa gidildikçe enerji düzeyi numarası değişmez. Başka bir deyişle enerji düzeyi değişmez. Ancak çekirdek yükü yani proton sayısı artar. Bu da elektronların daha kuvvetli çekilmesini sağlar ve elektronlar çekirdeğe daha yakın durur. Dolayısı ile atom yarıçapı giderek küçülür.
Bir grupta yukarıdan aşağı inildikçe, her yeni periyotla birlikte çekirdek etrafına yeni bir enerji düzeyi eklendiği için atom yarıçapı, başka bir deyişle atom hacmi büyür.
İyonlaşma Enerjisi
Gaz halindeki bir atomdan veya iyondan bir elektron koparmak için verilmesi gerekli minimum enerjiye iyonlaşma enerjisi denir. Bir elektron koparmak için gerekli enerjiye 1. iyonlaşma enerjisi, 2. elektronu koparmak için gerekli enerjiye 2.iyonlaşma enerjisi denir. 2. iyonlaşma enerjisi 1. den, 3. iyonlaşma enerjisi de 2. den daima daha büyüktür. Son enerji düzeyindeki elektronlar az enerji ile koparılırlar. Ayrıca son enerji düzeyinde ne kadar az elektron varsa elektronların kopması için o kadar az enerjiye gereksinim duyulur. Bu yüzden genelde bir periyot boyunca soldan sağa iyonlaşma enerjisi artar. 1A’dan 8A’ya gidildikçe elektron koparmak zorlaşır. Bir periyotta 1A grubundaki elementin iyonlaşma enerjisi en küçük, 8A grubundaki elementin iyonlaşma enerjisi en büyüktür.
Bir grupta yukarıdan aşağı atom yarıçapı büyüyeceği için çekirdek, elektron daha zayıf kuvvetle çeker. Bunun sonucunda elektron az enerji ile koparılır. Öyle ise grupta yukarıdan aşağı iyonlaşma enerjisi azalır.
Elektron İlgisi
Gaz halinde bulunan bir atomun bir elektron alırken dışarı verdiği minimum enerjiye elektron ilgisi denir. Ametal elementler elektron alabileceği için bir periyot boyunca soldan sağa doğru elementlerin elektron ilgisi artar. Ametal özellikteki elementlerin yer aldığı gruplarda yukarıdan aşağı elektron ilgisi azalır.
İncelediğimiz özellikler dışında elementlerin değerlilik elektron sayıları bir periyot boyunca soldan sağa artar, bir grupta ise değişmez. Enerji düzey sayıları bir periyotta bütün elementler için aynıdır fakat yukarıdan aşağı artar.
Bir Elementin Periyodik Cetveldeki Yerini Bulma
Atom numarası verilen bir elementin periyodik cetvelde yer aldığı periyot ve grubu bulmak için önce o element atomunun elektron dağılımını yazmak gerekir. Elektron dağılımında son enerji düzeyi numarası elementin bulunduğu periyot numarasını, değerlik elektron sayısı grup numarasını, son orbital ise grup türünü verir. Son orbital türü s ve p olduğunda o element A gruplarında, d olduğunda ise B gruplarından birinde yer alır.
Örnek 4.1 Atom numarası 13 olan A1 elementinin cetveldeki yerini bulunuz.
Çözüm: Nötr atomda;
Atom numarası = Proton sayısı = Elektron sayısı eşitliği biliniyor.
Buna göre A1 atomunun elektron dağılımı;
2 1 Değerlik elektronu = Grup numarası = 3
1s22s22p6 3 s 3 p Son orbital türü = Grup türü = A grubu
Son enerji düzeyi numarası = Periyot numarası = 3
Buna göre element 3 periyot 3A grubundadır.
Örnek 4.2 Periyodik cetvelin 4. periyodunda ve 2A grubundaki elementin atom numarası nedir?
Çözüm:
Periyot numarası son enerji numarası olduğuna göre bu elementin son enerji düzeyi 4 olmalıdır. 2A grubunda olduğuna göre 2 değerlik elektronu bulunmalıdır. Buna göre elektron dağılımı yazılır ve toplam elektron sayısı tespit edilir.
1s22s22p63s2p3p64s2
Elektron sayısı nötr atomda atom numarasına eşittir ve 20’dir.
İyonlar
Bir element atomunu nötr iken incelediğimizde yapısında başlıca iki yüklü tanecik bulunduğunu tespit ederiz. Bunlar çekirdekte yer alan + yüklü protonlar ve çekirdek etrafında hareket eden – yüklü elektronlardır. Proton elektron sayısı birbirine eşit olduğunda atom nötr, yani yüksüzdür.
Atomun yapısındaki elektron sayısının değişimi proton-elektron eşitliğini bozar ve atom yüklü hale geçer. Yüklü atom veya atom gruplarına iyon denir.
